Antecedentes de la tabla periódica

Da clic en cada botón para conocer la información.

Tríadas de Döbereiner

Döbereiner fue prácticamente un autodidacta; consiguió que un personaje de la nobleza le ayudara a conseguir un puesto como profesor de Química y Física en la Universidad de Jena; descubrió el compuesto llamado furfural, y estudió las propiedades catalíticas del platino (un catalizador es una sustancia que acelera la velocidad con que reaccionan las sustancias químicas, sin que sea consumido), sobre todo el efecto que tiene en la inflamación del hidrógeno, fenómeno conocido con el nombre de Eslabón de Döbereiner.
En 1829 Döbereiner descubrió que algunos elementos químicos estaban emparentados entre sí debido a que presentaban propiedades químicas y físicas muy parecidas y se diferenciaban unos de otros en una forma gradual. Por ejemplo, el bromo tenía características intermedias entre el cloro y el yodo. De hecho, cuando Liebig se topó con él no lo consideró un nuevo elemento sino que creyó que se trataba de una mezcla de estos dos elementos.
Estos grupos se presentaban en tercias y se conocieron como Triadas de Döbereiner. Una característica importante era que el peso atómico del elemento de en medio era el promedio de los otros dos. Aparte del cloro (35.3 uma), bromo (80 uma) y yodo (127 uma) otras tríadas descubiertas por él fueron: litio (7 uma), sodio (23 uma) y potasio (39 uma); calcio (40 uma), estroncio (88 uma) y bario (137 uma); azufre (32 uma), selenio (79 uma) y telurio (128 uma), pero al no encontrarse otras series con estas características este descubrimiento fue tomado como una mera curiosidad, sin ningún significado teórico o práctico.

Hélices de Chancourtois

Chancourtois era profesor de mineralogía en París e inspector de minas de Francia, fue en esta posición donde desempeñó una importante labor al emitir normas de seguridad que protegían la integridad de los mineros.
En 1862 realizó el ejercicio de ordenar los elementos químicos, disponiéndolos en orden creciente con respecto a su peso atómico en una gráfica en tres dimensiones.
Lo anterior dio como resultado una curva helicoidal en el espacio, de tal suerte que los pesos atómicos de los puntos que se correspondían en las sucesivas vueltas de la hélice diferían en dieciséis. Observó que los elementos con propiedades semejantes estaban situados cerca de los puntos correspondientes y que “las propiedades de los elementos son las de los números” (Pauling, 1980, p.101).
Su estudio se publicó de forma original sólo como un texto debido a que se omitió el diagrama y además a que Chancourtois utilizó términos geológicos, por tal razón los químicos y científicos, en general, no lo entendieron, a causa de ello su tornillo telúrico no tuvo mayor aceptación (ver Figura 1).

Figura 1. EcuRed. Conocimiento con todos y para todos. (s.f.) Hélices de elementos [Imagen]. Recuperada de http://bit.ly/1HnCWxR

Octavas de Newlands

Hacia 1863 Newlands desarrolló un sistema de clasificación de los elementos, según el orden de los pesos atómicos en el que éstos se dividían en siete grupos de siete elementos cada uno. Llamó a su relación ley de las octavas por su analogía a los siete intervalos de la escala musical.
Sin embargo, su ley resultó inadecuada para elementos de mayor masa que el calcio.
Debido a esta razón, cuando Newlands presentó su estudio en 1864 durante una reunión de científicos no fue tomado en serio. El presidente del congreso le preguntó sarcásticamente si la clasificación por orden alfabético no tenía todas las posibilidades de manifestar una armonía insospechada entre los elementos. Newlands no consiguió que su trabajo fuera publicado.
No fue sino hasta que Mendeléiev logró un éxito rotundo con su tabla que se reconoció el trabajo de Newlands. Fue reivindicado y premiado por la Royal Society con la medalla Davy hasta 1887. Por esta razón, en la actualidad se le llama a Newlands el desconocido padre de la tabla periódica.


Clasificación de Mendeléiev

Cuando era profesor de Química, Mendeléiev intentó clasificar los sesenta y tres elementos químicos conocidos en su época, para ello hizo un estudio completo de la relación entre los pesos atómicos de los elementos y sus propiedades físicas y químicas, en especial con respecto a la valencia.
Cuando era profesor de Química, Mendeléiev intentó clasificar los sesenta y tres elementos químicos conocidos en su época, para ello hizo un estudio completo de la relación entre los pesos atómicos de los elementos y sus propiedades físicas y químicas, en especial con respecto a la valencia.
Mendeléiev propuso un sistema periódico que contenía diecisiete columnas, semejante en términos generales al actual, con excepción de los gases nobles (debido a que los gases nobles no se habían descubierto en esa época). En 1871, él y el químico alemán Lothar Meyer (1830-1895), quien trabajaba independientemente, propusieron un sistema con ocho columnas, obtenidas al dividir cada uno de los periodos largos en periodos de siete elementos; un grupo octavo contenía los tres elementos centrales (como Fe, Co y Ni) y un segundo periodo siete elementos. Tanto el primero como el segundo periodo se distinguieron, posteriormente, con las letras A y B, agregadas a los números de los grupos que se señalaban con números romanos.
Este nuevo arreglo de los elementos era particularmente bueno, pero iba más allá. Mendeléiev tenía mucha confianza en su tabla periódica; se atrevió a disponer algunos elementos en un orden que era contrario al que correspondía por sus pesos atómicos y retó a los químicos a ponerla a prueba.
En aquellas fechas se le asignaba al berilio un peso atómico de 14, pero en la tabla de Mendeléiev no había espacio para un elemento con ese peso y lo colocó junto al magnesio, entre el litio y el boro, o sea, que le debería corresponder un peso atómico de aproximadamente 9 y, de manera similar, afirmó que los químicos estaban equivocados en los pesos del uranio y del indio. Sin embargo, lo más arriesgado en su propuesta fue la predicción de nuevos elementos. Para que su tabla funcionará tuvo que dejar algunos huecos en ella y señaló que correspondían a elementos que aún no habían sido descubiertos: los llamó ekaboro, ekasilicio y ekaaluminio.

Figura 2. Wikimedia Commons (1891). The periodicity of the elements. Recuperada de http://bit.ly/1cAadx6
El sistema periódico propuesto por Mendeléiev (periodo corto) fue muy popular durante mucho años, sólo hasta 1950 comenzó a ser reemplazado por la forma de periodo largo.
El grupo cero se añadió al sistema periódico después del descubrimiento de lord Rayleigh y sir William Ramsay (posterior a 1894) sobre los gases inertes.
Una forma muy parecida a la mostrada en la figura fue ideada en 1895 por Julius Thomsen (1826-1909).
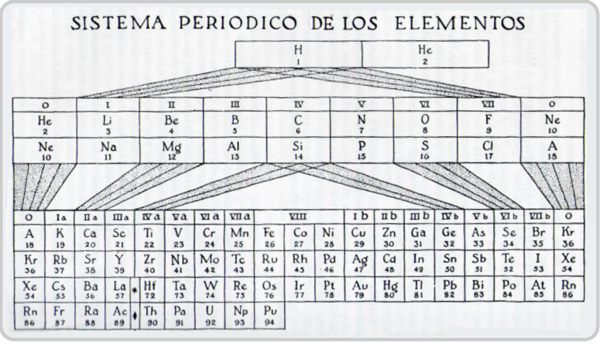
Figura 4. Sistema periodico(sic) de los elementos [Imagen]. Recuperada de Pauling, L. (1980). Química general. Aguilar.
Después de que Thomsen descubriera el electrón y de que Rutherford desarrollara la teoría nuclear, el físico holandés A. van den Broek, en 1911, sugirió que la carga nuclear ordinal, en la actualidad llamada número atómico, debía ser igual al número ordinal del elemento en el sistema periódico.

Clasificación de Moseley

Unos meses después de la presentación de la teoría de Bohr, en 1913, un joven inglés, Henry Gwyn Jeffreys Moseley, realizó un estudio sistemático sobre las líneas K de diez elementos (Ca, Ti, V, Cr, Mn, Fe, Co, Ni, Cu y Zn) y en 1914 los amplió a más de cincuenta.
De forma más simple, Moseley llevó a cabo experimentos con rayos X, con ellos descubrió que: “Los rayos X varian en frecuencia de acuerdo con el metal utilizado en el anodo” (De los Ríos 2011, p. 301). Además, relacionó las frecuencias con las cargas nucleares (Z).
De la regularidad de sus resultados, Moseley destacó la ausencia de un elemento entre el Ca y el Ti: el escandio. Además, estudió los espectros de Co y Ni, con pesos atómicos semejantes, estos estudios revelaban que el cobalto debía preceder al níquel en la tabla periódica. Resultados de análisis posteriores indicaron que existe una relación lineal entre la raíz cuadrada de la frecuencia de la emisión de rayos X y el número atómico (Z).
Dicho estudio permitió a Moseley predecir nuevos elementos (Z=43 [descubierto en 1937], 61 [descubierto en 1945], 75 [descubierto en 1925]). Además, Moseley probó la bondad de la ley periódica (se llama ley periódica al hecho de que las propiedades de los elementos cambien en forma progresiva al recorrer la tabla) entre Z=13 y 79, donde afirmó que no podría haber otros elementos nuevos en esta región debido a que todos los números atómicos disponibles habían sido asignados.
A partir de los estudios de Moseley pudieron conocerse con certeza los números atómicos de casi todos los elementos. No pasó mucho tiempo para que se comenzara a entender la constitución electrónica de los elementos y se explicara su comportamiento periódico.
Tabla periódica actual
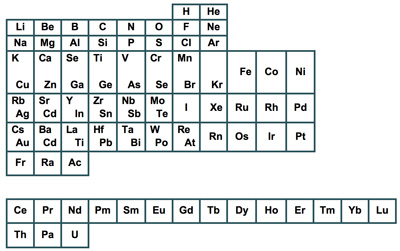
Como podrás observar, más adelante se muestra la tabla periódica moderna en la que los elementos están acomodados conforme a su número atómico (el cual aparece sobre el símbolo del elemento) en filas horizontales llamadas periodos (1-7) y en columnas verticales conocidas como grupos o familias (1-18), de acuerdo con sus semejanzas en las propiedades químicas.
Los elementos se dividen en tres categorías:
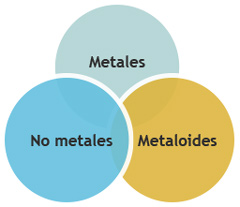
Un metal es un buen conductor del calor y la electricidad, en tanto que un no metal generalmente es un mal conductor de ambas energías. Un metaloide presenta propiedades intermedias entre los metales y los no metales.
En la tabla periódica (ver Figura 5) se puede observar que de los elementos que se conocen sólo diecisiete son no metales y ocho son metaloides. De izquierda a derecha, a lo largo de cualquier periodo, las propiedades físicas y químicas de los elementos cambian en forma gradual (ley periódica).
Este capítulo te da a conocer de forma concreta la historia de la tabla periódica. Una vez sentadas las bases, en los capítulos subsecuentes comprenderás la construcción de la tabla periódica actual y las curiosidades que encierra.


