Modelos atómicos
A través de los siglos, el hombre ha especulado acerca de la naturaleza de las partículas esenciales de la materia.
A simple vista, la materia aparece como una masa continua, sin embargo, la evidencia experimental ha probado que está formada por partículas sumamente pequeñas. Estas partículas son los átomos, tienen las propiedades del elemento del que forman parte y están compuestos por partículas más pequeñas.
Tanto los átomos como las partículas subatómicas son tan pequeñas que resulta difícil compararlas con cualquier objeto conocido.
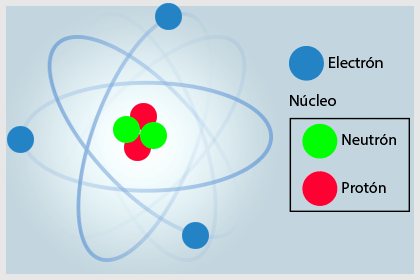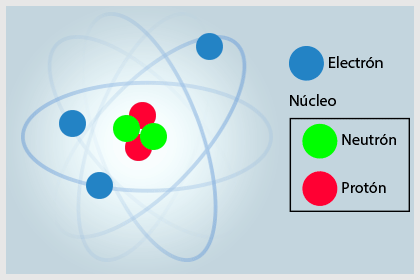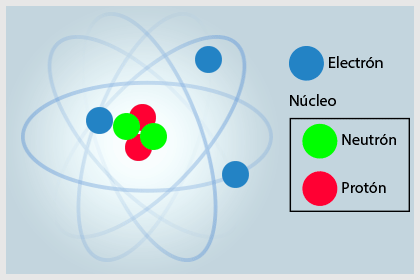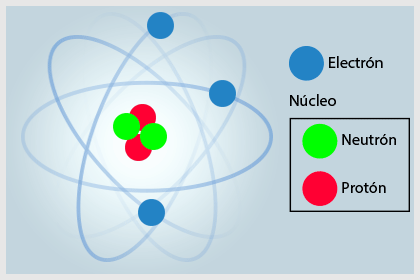
Los físicos han logrado medir el volumen ocupado por una cierta cantidad de átomos y a partir de ahí han logrado calcular el volumen de cada una de las partículas. La unidad que se usa para medir el tamaño de los átomos es el ångström (Å). El tamaño de los átomos varía desde 1 Å para el H2 hasta 5 Å para el átomo de cesio. Para poder llegar a estos conocimientos ha tenido que pasar mucho tiempo y mucha investigación por parte de diversos científicos interesados en el estudio de la materia y en los fenómenos de la misma.

Historia del Átomo. [Archivo de video]. Recuperado de https://youtu.be/Xd_g96ZhsQg
Para conocer más del tema, da clic en cada uno de los teóricos para ver la información.

Demócrito de Abdera 460 a.C.-370 a.C.

Demócrito, pensador griego en el siglo IV antes de Cristo observó que a simple vista las sustancias eran continuas pero se podían dividir; se preguntó si era posible dividir una sustancia indefinidamente. Pensaba que no, que llegaba un momento en que se obtenían unas partículas que no podían ser divididas más, a esas partículas las llamó átomo, que proviene del griego y significa indivisible.
Cada elemento tenía un átomo con unas propiedades y formas específicas, distintas de las de los átomos de los otros elementos, no obstante, sus ideas sin estar olvidadas completamente cayeron en desuso durante más de dos mil años. Sin embargo, continúo el estudio de las sustancias, se desarrolló la Química y se hicieron muchos descubrimientos y leyes que rigen el comportamiento de la materia.

John Dalton (1766 – 1844)

En 1808 Dalton propuso una teoría atómica; según esta teoría los elementos estaban formados por átomos, indivisibles e indestructibles, todos iguales entre sí pero distintos de los átomos de los otros elementos.
La unión de los átomos daba lugar a la variedad de sustancias conocidas y la ruptura de las uniones entre los átomos formaba nuevas uniones, esto era el origen de las transformaciones químicas.

Esta teoría constituyó la base para el desarrollo de la Química.
Revisa el siguiente enlace en donde encontrarás información relevante acerca del modelo atómico de Dalton.
Recuperado de https://youtu.be/vdIp0OeLR3k

Joseph John Thomson (1856 – 1940)

El físico danés Thomson creyó que el átomo estaba formado por una esfera de carga positiva en la que se incrustaban los electrones como pasas en un pastel.
Cuando Thomson propuso su modelo atómico se sabía que los átomos eran neutros.
El átomo se encuentra formado por una esfera de carga positiva en la cual se encuentran incrustadas las cargas negativas (electrones) de forma similar a como se encuentran las pasas en un pastel. Además, como el átomo es neutro la cantidad de cargas positivas es igual a la cantidad de cargas negativas.


Ernest Rutherford (1871-1937)

El experimento de Rutherford consistía en bombardear una fina lámina de oro con rayos alfa. Para observar el resultado de dicho bombardeo alrededor de la lámina de oro colocó una pantalla fluorescente. Observó que:

Al observar los resultados de su experimento llegó a las siguientes conclusiones:

Por los experimentos que hizo y las conclusiones a las que llegó, Rutherford propuso, en 1911, este modelo del átomo:

Para analizar cuál era la estructura del átomo, observa el experimento de Rutherford.
• La mayoría de los rayos alfa atravesaban la lámina sin sufrir desviación
• Algunos se desviaban
• Muy pocos rebotaban
Al observar los resultados de su experimento llegó a las siguientes conclusiones:
• La mayoría del átomo estaba vacío
• Algunos rayos se desviaban porque pasanban muy cerca de centros con carga eléctrica
Para experimentos que hizo y las conclusiones a las que llegó, Rutherford propuso este modelo del átomo en 1911.
Revisa el siguiente video que te permitirá reforzar tus conocimientos acerca del tema.
• DFIE IPN (2015) Modelo Atómico de Rutherford.[Archivo de video]. Recuperado de https://youtu.be/IszdxJb4YEc

Niels Bohr (1885 – 1962)

Otro científico que también estudió el átomo basándose en los estudios hechos por Thomson, Rutherford y otros fue Bohr.
Para realizar su modelo atómico, Bohr utilizó el átomo de hidrógeno. Describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. En este modelo los electrones giran en órbitas circulares alrededor del núcleo, ocupando la órbita de menor energía posible, es decir, la órbita más cercana al núcleo.
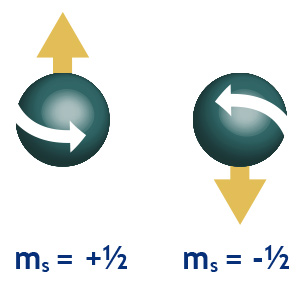
En 1913 Bohr explicó la existencia de los espectros atómicos al suponer que los electrones no giran en torno al núcleo atómico en cualquier forma sino que están en niveles de energía, cada nivel energético que identifica a cada una de las órbitas toma valores desde 1 a 7 (con números enteros); se representa con la letra n y recibe el nombre de:
Número cuántico principal, el cual determina la distancia al núcleo y el radio de la órbita. De acuerdo al número cuántico principal, calculó las distancias a las cuales se hallaba del núcleo cada una de las órbitas permitidas en el átomo de hidrógeno.
Con base en lo anterior, Bohr propuso su modelo para el átomo, comparándolo con el sistema solar. En el modelo de Bohr los electrones giran en órbitas alrededor del núcleo que es el centro del átomo, se consideran las fuerzas de atracción eléctrica entre las cargas del núcleo que son positivas y los electrones que tienen carga negativa.

El modelo de Bohr funcionaba muy bien para el átomo de hidrógeno, pero en el espectro realizado para otros átomos se observó que los electrones de un mismo nivel energético tenían distinta energía. Algo andaba mal, la conclusión fue que dentro de un mismo nivel energético existían subniveles.
Para profundizar en el tema, en el siguiente enlace revisa el Modelo atómico de Bohr.
Recuperado de http://goo.gl/TMjXsW

Arnold Sommerfeld (1868 – 1951)

En 1916 Arnold Sommerfeld modificó el modelo atómico de Bohr en el cual los electrones sólo giraban en órbitas circulares al decir que también podían girar en orbitas elípticas.
Lo anterior dio lugar a un nuevo número cuántico: el número cuántico azimutal que determina la forma de los orbitales, se representa con la letra l y toma valores que van desde 0 hasta n-1 y determina la excentricidad de la órbita.
Para profundizar en el tema, en el siguiente enlace revisa el Modelo atómico de Sommerfeld.
Recuperado de https://prezi.com/cwwvllel513u/modelo-atomico-de-sommerfeld/

Louis-Victor de Broglie (1892-1987) y Werner Heisenberg (1901-1976)

En 1923 Louis-Victor de Broglie fue quien sugirió que los electrones tenían tanto propiedades de ondas como propiedades de partículas, esta propuesta constituyó la base de la mecánica cuántica. A consecuencia de este comportamiento dual de los electrones (como onda y como partícula) surgió el principio enunciado por Werner Heisenberg, conocido también como principio de incertidumbre, el cual dice:
Así surge un nuevo concepto, el orbital atómico. Es la región del espacio en la que existe mayor probabilidad de encontrar al electrón. Ya en la década de 1920 se propuso, gracias a los esfuerzos de Schrödinger, Heisenberg y el propio Bohr, la teoría de la mecánica cuántica que da explicación del comportamiento de los electrones y átomos, individualmente, en compuestos y en las transformaciones químicas. Se tienen ya los cuatro números cuánticos que detallan el ordenamiento de los electrones en el átomo y describen la estructura cuántica del mismo, así como lo que pasa dentro de él.

Erwin Schrödinger (1887-1961)

El modelo de Schrödinger, con sus niveles y subniveles, explica perfectamente la estructura del átomo y nos da la forma geométrica de la densidad electrónica probable en cada uno de los niveles y subniveles de energía.

A continuación te presentamos un material que puede servirte para apoyar el estudio de este tema.
•Phet Interactive Simulations. (2015). Modelos del Átomo del Hidrógeno.
Recuperado de https://phet.colorado.edu/es/simulation/hydrogen-atom
Consideraciones generales:
1. Para ver el recurso Modelos del Átomo del Hidrógeno, da clic en la liga https://phet.colorado.edu/es/simulation/hydrogen-atom
2. Da clic en el botón: ¡Iniciar ahora!

Importante: Para funcionar, el interactivo necesita la versión actualizada de java, la misma aplicación te dirigirá para obtenerla y/o actualizarla.
3. Listo, enseguida podrás visualizar el interactivo.

Iglesias, F., De Monte, Z. & Francia, M. (2014). Modelos Atomicos (sic).
Recuperado de https://prezi.com/od7m3gpvvsxa/modelo-atomico-de-rutherford/

http://bit.ly/1y7Mut4
http://bit.ly/19Qpx8n
http://bit.ly/1GmLdoW
http://bit.ly/19lHGd7
http://bit.ly/1CYXMak
http://bit.ly/1Cbe38E
http://bit.ly/1OzcI21
http://bit.ly/1xzRHiy
